
© dpa
Nobelpreis für Chemie 2014: Mit besseren Mikroskopen in die Nanowelt
Wo Biologen bislang mit den besten Lichtmikroskopen nur einen Schatten erkennen konnten, können sie jetzt auf der Oberfläche lebender Nervenzellen einzelne Proteine und Strukturen erkennen - dank des deutschen Nobelpreisträgers Stefan Hell. Dabei wurde er lange nur belächelt.
An einem Herbsttag vor 21 Jahren hatte der damals 30-jährige Stefan Hell in einer Studentenbude im finnischen Turku eine verrückte, fast schon anmaßende Idee. Der Physiker war sich sicher, dass er eine Grenze durchbrechen kann, die der Physiker Ernst Abbe 1873 als unüberwindbar beschrieben hatte: Die höchstmögliche Auflösung des Lichtmikroskops. Am Mittwoch bekam Hell den Chemie-Nobelpreis dafür zuerkannt, Abbe umgangen und eine „Nanoskopie“ möglich gemacht zu haben: Bilder aus lebenden Zellen in Millionstel Millimeter scharfer Auflösung.
„Auch wenn Stefan Hell die Technik schon Mitte der 1990er entwickelt hat, ist das ein ,früher’ Nobelpreis“, sagt Volker Haucke, der neue Direktor des Berliner Leibniz Instituts für Molekulare Pharmakologie. „Wir fangen gerade erst an, diese Technik so richtig schätzen zu lernen.“
Empfohlener redaktioneller Inhalt
An dieser Stelle finden Sie einen von unseren Redakteuren ausgewählten, externen Inhalt, der den Artikel für Sie mit zusätzlichen Informationen anreichert. Sie können sich hier den externen Inhalt mit einem Klick anzeigen lassen oder wieder ausblenden.
Ich bin damit einverstanden, dass mir der externe Inhalt angezeigt wird. Damit können personenbezogene Daten an Drittplattformen übermittelt werden. Mehr Informationen dazu erhalten Sie in den Datenschutz-Einstellungen. Diese finden Sie ganz unten auf unserer Seite im Footer, sodass Sie Ihre Einstellungen jederzeit verwalten oder widerrufen können.
Wo Biologen bislang mit den besten Lichtmikroskopen nur einen Schatten erkennen konnten, können sie jetzt auf der Oberfläche lebender Nervenzellen einzelne Proteine und Strukturen erkennen. Hauckes Institut will deshalb für die Alzheimer- und Epilepsie-Forschung demnächst ein knapp eine Million Euro teures Mikroskop bestellen, das auf der Technik beruht, die Hell entwickelt hat. Denn vielleicht liegt der Schlüssel zu diesen Krankheiten im Verständnis nanometerfeiner Strukturen auf Nervenzellen. Dank Hell erkennen Forscher jetzt, wie sich diese Strukturen verändern, wenn Nervenimpulse übertragen werden.
Eine Zeit lang wurde Hell belächelt
Bis dahin war es ein weiter und steiniger Weg für Hell. „Er wurde lange belächelt“, sagt Zellbiologe Haucke, der eine Zeit lang mit ihm in Göttingen forschte. „Das ist ein grundlegendes Problem in der Forschung, dass Leute, die etwas wirklich Neues versuchen wollen, nur selten die nötige Unterstützung finden.“ Und was Hell probieren wollte, war in der Tat etwas so Neues, das viele es für unmöglich hielten. Zu unumstößlich schien das Abbe’sche Gesetz.
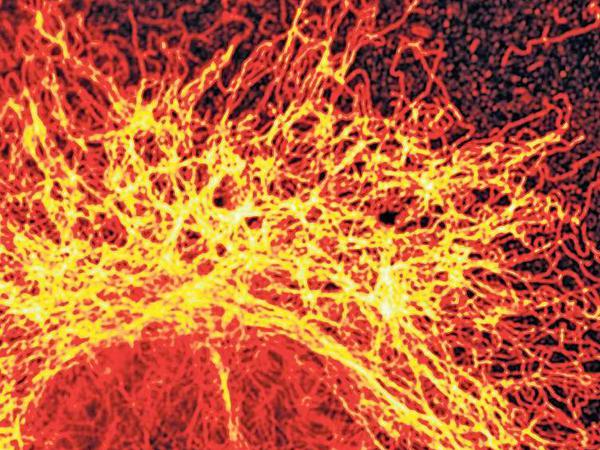
Laut Ernst Abbe diktiert die Wellenlänge des Lichts die Grenze der Auflösung eines Lichtmikroskops. Zwei Punkte verschwimmen dann zu einem einzigen, wenn sie weniger als 200 Nanometer (Millionstel Millimeter) voneinander entfernt sind. So ist in einer Zelle zwar der Kern gut sichtbar, weil er satte 5000 Nanometer groß ist. Der nur zwei Nanometer breite Erbgutfaden im Inneren ist jedoch nur als grauer Schatten zu erkennen. Und auch die durchschnittlich zehn Nanometer großen Proteine, die das Erbgut umsorgen, Stoffe transportieren und die Zelle am Leben halten, bleiben undifferenzierbar. „Es ist, als ob man die Gebäude einer Stadt sieht, aber nicht die Menschen, die darin leben“, beschreibt das Nobelpreis-Komitee die Grenzen der Biologie wie sie vor Stefan Hell galten.
Der Forscher musste sich als Einzelkämpfer durchsetzen
Hells Trick, die Abbe’sche Grenze zu unterlaufen, ist im Grunde simpel: Licht an, Licht aus. Hell schmökerte damals in seiner Studentenbude in einem Text, der sich mit fluoreszierenden Molekülen beschäftigte. Wenn Licht einer bestimmten Wellenlänge auf sie fällt, leuchten sie. Aber wie lassen sich solche Moleküle wahrnehmen, wenn sie sehr dicht beieinander liegen – dichter als Abbes 200 Nanometer? Als Hell davon las, dass sich die Fluoreszenzmoleküle mit Hilfe eines Lasers auch ausschalten lassen, ging ihm - buchstäblich - ein Licht auf: Wenn zwei so dicht nebeneinander liegende Moleküle nacheinander fluoreszieren würden, also immer nur eines leuchtet, das andere aber ausgeschaltet ist, dann sollte sich aus den zwei Bildern davon ein Gesamtbild zusammensetzen lassen, in dem beide Punkte aufgelöst werden können. Die Auflösung könnte auf 20 bis 30 Nanometer verbessert werden, ein Zehntel der Abbe’schen Grenze.
© DKFZ
Als Hell seinem finnischen Professor die Idee präsentierte, verzog dieser keine Miene. „Auf dem Papier“ sehe das zwar gut aus, aber daran glauben, dass es funktioniert, wollte er nicht. So ging es Hell jahrelang. Niemand in Deutschland wollte ihm Geld und Laborplatz gewähren, um die Idee zu testen. Hell gab nicht auf, ging mit der Idee jahrelang hausieren, meldete die Technik sogar auf eigene Kosten zum Patent an. Nur die Finnen konnte er überzeugen. Und nachdem er dort zeigen konnte, dass die Idee prinzipiell funktionierte, gab ihm das Göttinger Max-Planck-Institut eine Chance.

© DKFZ
Inzwischen ist aus der Idee die STED-Technik geworden, auf deutsch "Stimulierte Emissionsauslöschung". Dabei regt ein Laserstrahl ein oder mehrere Moleküle zum Leuchten an, aber ein zweiter, ringförmiger Laser schaltet die Fluoreszenz aller anderen drum herum aus. Lediglich im Zentrum des Ringes, der wenige Nanometer eng sein kann, können deshalb Moleküle leuchten. Die Laser tasten die Probe Punkt für Punkt ab und ein Computer setzt daraus ein Bild zusammen.
Worauf der Forscher zukünftig hofft
So sehr Hell sich als Einzelkämpfer durchboxen musste, er war nicht der einzige, der die Abbé-Grenze knacken konnte. Mit Hell zeichnete das Nobelkomitee auch die US-amerikanischen Forscher Eric Betzig vom Howard Hughes Medical Institute in Ashburn, und William Moerner von der Universität Stanford in Kalifornien aus, Auch sie setzten auf das Prinzip „Licht an, Licht aus“. Doch anders als Hell, lassen Betzig und Moerner pro Bild viele Moleküle gleichzeitig leuchten, allerdings zeitlich beschränkt und so, dass statistisch jeweils nur nicht eng benachbarte Moleküle leuchten. „Das ist wie beim Malen eines pointillistischen Bildes“, sagt Haucke. Hier ein paar Punkte, da ein paar Punkte, und wenn man dann einen Schritt zurücktritt, wird aus den vielen einzelnen Punkten ein Gesamtbild“.
Prinzipiell ist mit diesen Methoden der Auflösung keine Grenze gesetzt, sagt Hell. Er hofft, eines Tages Details von Molekülen sichtbar machen zu können. Trotz der Startschwierigkeiten, trägt Hell Deutschland nichts nach. Ein verlockendes Angebot der Harvard Universität hat er abgelehnt und bleibt am Göttinger Max-Planck-Institut bzw. am Deutschen Krebsforschungszentrum in Heidelberg, wo er ebenfalls ein Labor hat. „Wenn eine Idee mächtig ist, dann ist sie nicht aufzuhalten“, sagt Hell. „Und die Idee, dass es Lichtmikroskopie jenseits der Abbe-Grenze gibt, war sehr mächtig.“ (Mitarbeit: Uta Deffke)
- showPaywall:
- false
- isSubscriber:
- false
- isPaid:
- showPaywallPiano:
- false