© Focus/SPL JBX
Antibiotikaresistenz: Stumpfe Wunderwaffen
Der Welt gehen die Antibiotika aus – und kaum jemand tut etwas dagegen. Das liegt an mehreren Problemen. Eines davon: Antibiotika sind nicht profitabel.
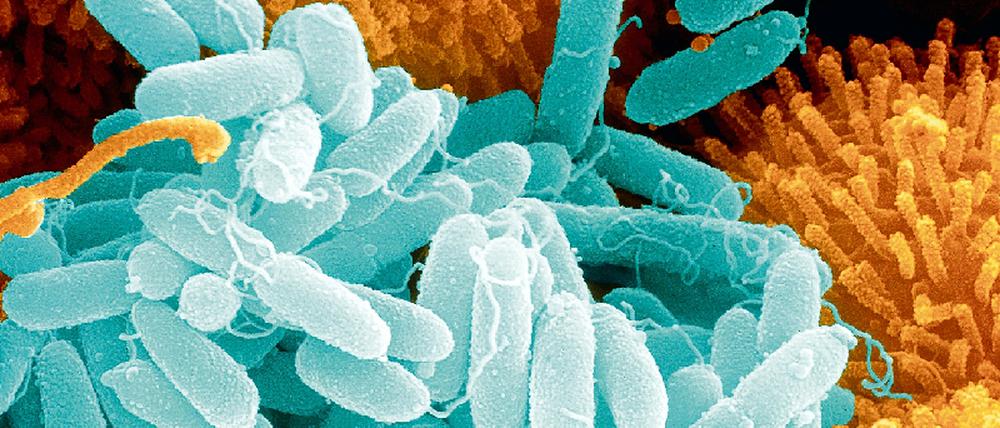
Die Bedrohung trägt komplizierte Namen. Acinetobacter baumannii zum Beispiel oder Pseudomonas aeruginosa. Immer häufiger verursachen diese Bakterien Erkrankungen, die sich mit bewährten Medikamenten nicht mehr behandeln lassen. „Das ist ein schreckliches Bild“, sagt Tim Eckmanns von der Abteilung Infektionsepidemiologie des Robert-Koch-Instituts (RKI). „Da bekommt der Arzt nach den Tests einen Bogen wieder und hinter jedem Antibiotikum steht ein R für resistent.“
Der einzige Ausweg für den Arzt: Medikamente, die für diese Krankheit nicht zugelassen wurden oder seit Jahrzehnten nicht mehr benutzt werden. Noch seien solche Fälle zum Glück äußerst selten, sagt Eckmanns. Auch an einem riesigen Klinikum wie der Charité gebe es jedes Jahr nur einige Fälle. „Aber die Situation wird immer schlechter.“
Lange hat der Mensch Bakterien in Schach halten können. Seine wichtigste Waffe sind dabei die Antibiotika. Aber wie ein Messer, das häufig benutzt wurde, ist die Waffe stumpf geworden. Mit dicken Hüllen schützen sich die Erreger, pumpen die Wirkstoffe einfach wieder aus dem Zellinneren heraus oder zerstören sie.
Acinetobacter baumannii und Pseudomonas aeruginosa sind nur die Speerspitze eines neuen Angriffs. Denn in der Natur herrscht ein ständiges Wettrüsten: Um das Gleichgewicht zu wahren, müssen sich die Abwehrmechanismen genau so schnell entwickeln, wie die neuen Methoden, sie zu umgehen. Biologen illustrieren das gerne mit dem Bild der „roten Königin“, die in „Alice im Wunderland“ erklärt, sie müsse so schnell rennen wie sie könne, um auf der Stelle zu bleiben. Der Mensch aber hat aufgehört, so schnell zu laufen wie er kann – und fällt deswegen zurück. Immer mehr resistente Keime machen Medizinern zu schaffen. Manche fürchten, es stehe ein „postantibiotisches Zeitalter“ bevor, in dem der Mensch wieder an besiegt geglaubten Erregern stirbt, weil sie auf keine Medikamente mehr reagieren.
Wie rasant sich Resistenzen ausbreiten können, hat man hierzulande bei Staphylococcus aureus beobachten können. Zu Beginn der neunziger Jahre ließ sich der Erreger fast immer mit dem Medikament Methicillin behandeln. Inzwischen ist der kugelförmige Keim bei jeder fünften Infektion resistent gegen das Antibiotikum.
Allein in den USA sterben nach Schätzungen von Experten jedes Jahr 19 000 Menschen an diesem hartnäckigen Erreger, kurz MRSA genannt. „In Deutschland gab es 2008 etwa 25 000 Infektionen“, sagt Eckmanns. Wie viele Menschen daran sterben, sei nur sehr schwer zu schätzen. „Es gibt zwar immer noch Alternativantibiotika“, sagt Petra Gastmeier vom Institut für Hygiene des Berliner Universitätsklinikums Charité. Aber Menschen, die resistente Erreger haben, sterben eher, weil das Antibiotikum, das sie zuerst bekommen, häufig nicht wirkt.
„Man vertrödelt Zeit und der Patient bekommt das richtige Antibiotikum möglicherweise zu spät“, sagt Gastmeier. Außerdem seien die Antibiotika der zweiten Wahl meist weniger effektiv und führten zu mehr Nebenwirkungen. Und einige Bakterien seien auch schon gegen die Alternativantibiotika resistent. „Es wird immer schwieriger“, sagt Gastmeier. „Das kann jeder sehen.“ Dass der Welt trotzdem langsam die Antibiotika ausgehen, liegt an mehreren Problemen.
Das Profitproblem
Antibiotika gehören zu den am meisten verkauften Medikamentengruppen in Deutschland. Für die Pharmaindustrie sind sie trotzdem wenig interessant. Denn normalerweise wird ein Antibiotikum nur wenige Tage eingenommen. „Medikamente, die Patienten über viele Jahre nehmen müssen, wie zum Beispiel Blutdrucksenker, sind viel profitabler“, sagt Gastmeier. Hinzu kommt, dass neue Antibiotika häufig für besonders schwere Fälle aufgehoben werden, also nur sehr selten zum Einsatz kommen. So soll verhindert werden, dass auch gegen die neuesten Antibiotika Resistenzen entstehen. Für Pharmafirmen macht es die Bakterienkiller aber noch weniger interessant.
Viele große Pharmafirmen haben sich deswegen aus dem Gebiet zurückgezogen. „Bayer, GlaxoSmithKline, Pfizer, Eli Lilly, die haben alle die Antibiotikaforschung eingestampft“, sagt Roderich Süssmuth, Professor für biologische Chemie an der Technischen Universität Berlin. „In Europa forschen von den großen Unternehmen nur noch Novartis und Sanofi Aventis auf dem Gebiet.“ Kein Wunder also, dass es kaum neue Antibiotika gibt. Der Abbau führe auch dazu, dass die Expertise auf dem Gebiet verloren gehe, warnt der Mikrobiologe Carl Nathan. Der Forscher von der Cornell-Universität in New York fordert deswegen eine Pharmafirma, die staatlich unterstützt wird und so unabhängig von finanziellen Interessen handeln kann.
Die Innovationslücke
Selbst wo das Geld vorhanden ist, lassen sich nur schwer wirklich neue Antibiotika finden. Die meisten, die heute benutzt werden, gehen auf Substanzen zurück, die zwischen Mitte der 30er Jahre und Anfang der 60er Jahre gefunden wurden. Abgesehen von einer Klasse seien alle Antibiotika, die zwischen 1960 und 2000 zugelassen wurden, Abwandlungen bestehender Antibiotika gewesen, schreiben die Pharmakologen Michael Fischbach und Christopher Walsh in einem Übersichtsartikel der Ende August in der Fachzeitschrift „Science“ erschienen ist. Immer wieder sind die alten Substanzen leicht verändert worden. Eine Armada von Chemikern hat den Gerüsten chemische Gruppen angefügt oder entfernt, um den Stoffen neue Eigenschaften zu geben. Von wirklicher Innovation keine Spur. Und wie lange sich die alten Gerüste noch verändern lassen ist ungewiss.
Fischbach und Walsh fordern deswegen, komplett neue Substanzen zu suchen. Außerdem solle man auch Antibiotika weiterentwickeln, die nur gegen wenige Erreger wirksam sind. Bisher sei aus Profitgründen vor allem versucht worden, Breitbandantibiotika herzustellen. Süssmuth hält es deswegen auch für richtig, sich alte Substanzen wieder anzuschauen, die man etwa in den 70er Jahren entdeckt, dann aber nicht weiterentwickelt hat.
Das Resistenzrätsel
Ein weiteres Problem: Niemand weiß, wie genau Resistenzen eigentlich entstehen. Der grundsätzliche Mechanismus scheint klar: Bei einer Infektion leben hunderte Millionen Bakterien im Menschen. Nimmt er Antibiotika, so werden die meisten getötet, aber unter der Vielzahl der Erreger befinden sich immer einige, denen der Wirkstoff weniger zusetzt und die sich deshalb weiter vermehren.
Doch da hört das Verständnis auch schon auf. Denn normalerweise tötet ein Antibiotikum die überwältigende Mehrheit der Keime und mit den restlichen (auch den resistenten) macht dann das Immunsystem kurzen Prozess. Im Idealfall bleiben also keine resistenten Bakterien übrig. Häufig heißt es deswegen, das größte Problem sei, dass Patienten Antibiotika absetzen, sobald sie sich besser fühlen. Die resistenten Keime wären dann noch nicht abgetötet.
George Drusano vom Ordway-Forschungsinstitut in Albany an der Ostküste der USA , einer der wenigen Experten auf dem Gebiet, hält das für falsch. In seinem Labor erforscht er, wie Erreger auf verschiedene Dosierungen und Therapien mit Antibiotika reagieren. „Das Problem ist nicht, dass Antibiotika zu kurz eingenommen werden“, sagt er. Im Gegenteil: Eine Antibiotikatherapie sei im Idealfall hart aber kurz. Häufig werde zu niedrig dosiert.
Auch wie Resistenzen im Einzelnen weitergegeben werden ist noch offen. Bakterien können Gene untereinander austauschen, das ist bekannt. „Das Problem ist, dass ein Antibiotikum vielleicht die Erreger in der Lunge töten soll, aber immer im ganzen Körper wirkt“, sagt Gastmeier. Möglicherweise werden so in eigentlich harmlosen Bakterien im Darm Resistenzen herangezüchtet, die diese dann an Krankheitserreger weitergeben.
Bei aller Unklarheit, fest steht: Länder wie Griechenland, wo Antibiotika besonders bedenkenlos verschrieben werden und häufig auch ohne Rezept zu bekommen sind, haben die größten Probleme. Skandinavien hingegen, wo Ärzte viel seltener Antibiotika verschreiben, haben weniger mit Resistenzen zu kämpfen. Eigentlich gebe es deswegen nur einen sicheren Rat, sagt Petra Gastmeier: „Wo es geht, sollte auf Antibiotika ganz verzichtet werden.“ Und das geht an einigen Stellen. „Zum Beispiel beim normalen Schnupfen“, sagt Eckmanns. „Den lösen nicht Bakterien aus sondern Viren, deshalb helfen da auch keine Antibiotika.“ Dasselbe gelte für die Grippe und auch für die meisten Nebenhöhlenentzündungen und Mittelohrentzündungen. „Es werden grundsätzlich viel zu viele Antibiotika verschrieben“, sagt er.
Das Ausbildungsdefizit
Das liegt auch daran, dass fast jeder Arzt diese Medikamente verschreibt. „Das machen Kardiologen, HNO-Ärzte, Chirurgen, jeder“, sagt Eckmanns. Es müsse deshalb viel mehr Fortbildungen für Ärzte geben, in denen ihnen der richtige Umgang mit Antibiotika erklärt werde.
„Man braucht viel mehr Experten auf dem Gebiet“, fordert Gastmeier. „So wie man heute im Krankenhaus einen Schmerztherapeuten hat, wird auch ein Experte für Antibiotika benötigt.“ Die Situation sei in den letzten Jahren schlechter und nicht besser geworden. Früher habe es wenigstens noch hauseigene Mikrobiologen gegeben, die beraten konnten. „Heute machen das meist Großlabore außerhalb des Krankenhauses.“ Schon bei den Medizinstudenten müsse man ansetzen, sagt Gastmeier. „Bei uns ist es so, dass die nur in wenigen Stunden Antibiotika vermittelt bekommen. Dabei ist das ein enormer Stoff.“
Auch bei den Bürgern, den Patienten, gebe es Nachholbedarf. „Die meisten Menschen denken immer noch, Infektionen werden über die Luft übertragen, über das Niesen, dabei werden sie meistens über die Hände weitergegeben“, sagt Gastmeier. Deswegen sei der wichtigste Rat: „Gründlich die Hände waschen.“
- showPaywall:
- false
- isSubscriber:
- false
- isPaid:
- showPaywallPiano:
- false