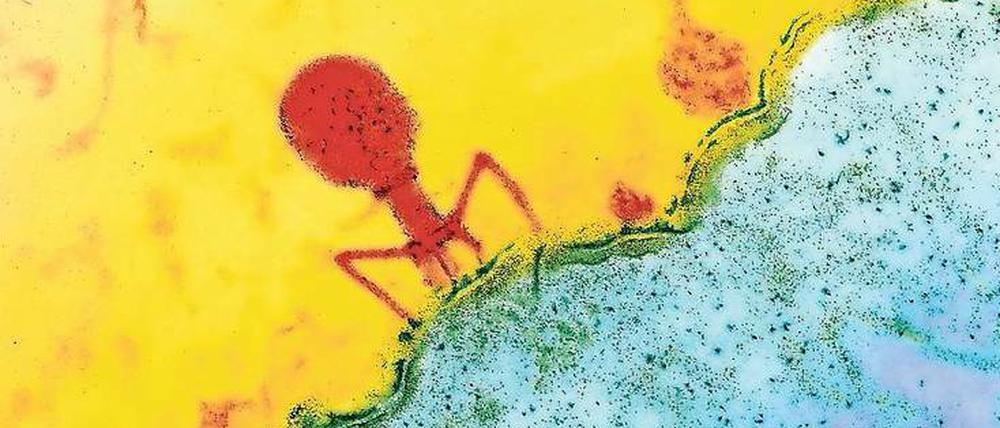
© Biozentrum Uni Basel
Wenn Antibiotika versagen: Heilsame Bakterienfresser
Mit genoptimierten Viren retten Ärzte einem Teenager das Leben nach einer Infektion mit multiresistenten Keimen.
Stand:
Es ist ein Szenario, das vielen Kindern droht, die an der Erbkrankheit Mukoviszidose leiden. Ihre Lungen verwandeln sich mitunter in ideale Brutstätten für Keime, weil der Gendefekt den Schleim in den Bronchien zähflüssig macht. Wenn es sich dabei um resistente Mikroben handelt, gegen die also kein Antibiotikum mehr wirkt, dann entwickelt sich schnell eine lebensgefährliche Situation.
Kaum noch Hoffnung bestand bei einer 15-jährigen Mukoviszidose-Patientin, Isabelle Carnell-Holdaway. In ihrer Lunge hatte sich ein solcher Erreger, das der Tuberkulose-ähnliche Mycobacterium abscessus festgesetzt. Trotz einer beidseitigen Lungentransplantation blieben die Bakterien, infizierten die Operationswunde, die Leber und über 20 Hautpartien am ganzen Körper. Mehr als einen Plan für die palliative Behandlung, die Sterbebegleitung, entwerfen, können Ärzte in solchen Fällen in der Regel nicht mehr tun. Ein Schicksal, das im Zuge des immer häufiger versagenden Arsenals an Antibiotika künftig auch immer mehr Menschen ohne Mukoviszidose drohen könnte.
Ein heilsamer Cocktail aus Viren namens „Muddy“, „ZoeJ“ und „BP“
Das Ärzteteam um Hellen Spencer vom Londoner Great Ormond Street Hospital wollte jedoch noch einen letzten Versuch wagen: die todbringenden Bakterien mit „bakterienfressenden“ Viren bekämpfen, sogenannten Bakteriophagen. Isabelles Mutter hatte von diesem experimentellen Therapieansatz gehört und den Phagenforscher Graham Hatful von der Universität Pittsburgh kontaktiert.
Aus einer Sammlung von über 10.000 verschiedenen Bakteriophagen suchte sein Team jene heraus, die den seltenen Typ Mykobakterien des Teenagers in Labortests besonders wirksam angreifen - „Muddy“, „ZoeJ“ und „BP“ genannt. Die beiden letzteren optimierte Hatfuls Team sogar noch mithilfe gentechnischer Veränderungen. Zuerst testeten die Forscher den Bakteriophagen-Cocktail an der Operationswunde am Brustbein, dann spritzten die Ärzte in London die Bakterienfresser alle zwölf Stunden in den Blutkreislauf des todkranken Mädchens – insgesamt drei Milliarden Phagen-Einheiten pro Dosis über einen Zeitraum von 32 Wochen.
Tatsächlich vermehrten sich die Viren im Körper zunächst, dann verschwanden die Bakterien allmählich, erst aus dem Blut, dann auch aus den Hautwunden. Nennenswerte Nebenwirkungen, etwa Fieber, traten nicht auf – im Gegenteil: Sechs Monate nach Behandlungsbeginn war die Operationswunde des Teenagers fast verheilt, die Hautläsionen waren – bis auf eine – verschwunden und Leber- und Lungenfunktion sowie das Gewicht des Teenagers hatten sich deutlich verbessert. Inzwischen ist Isabelle Carnell-Holdaway 17 Jahre, geht wieder zur Schule und lernt Autofahren, so die BBC. Die Infektion ist unter Kontrolle, aber ganz befreit ist die junge Frau von den Bakterien noch nicht und bekommt auch weiter Infusionen des Phagencocktails, berichtet die BBC.

© picture alliance / Arno Burgi/dpa
Ermutigend - aber noch lange kein Durchbruch für die Phagentherapie
Es ist die erste Behandlung einer Mykobakterium-Infektion mit Bakteriophagen, die erste Behandlung mit genetisch optimierten und vor allem eines der wenigen Beispiele für einen erfolgreichen Einsatz der Bakterienfresser. Von einem Durchbruch für die Therapieform, die seit Anfang des 20. Jahrhunderts existiert und immer wieder – mit widersprüchlichen Ergebnissen – getestet wurde, kann allerdings keine Rede sein. In ihrem Bericht, veröffentlicht im Fachblatt „Nature Medicine“, weisen Hatfull und Spencer ausdrücklich darauf hin, dass es sich um einen Einzelfall handelt und sie nicht ausschließen können, dass der Patient auch ohne die Phagenbehandlung gesund geworden wäre.
Doch der Fall ist ermutigend für Forscher und Ärzte, die in Bakteriophagen eine Möglichkeit sehen, gegen die steigende Zahl von Bakterienstämmen vorzugehen, gegen die herkömmliche und Reserve-Antibiotika nicht mehr wirken. Dazu gehört auch das deutsche Konsortium „Phage4Cure“, eine Kooperation des Leibniz-Instituts „Deutsche Sammlung von Mikroorganismen und Zellkulturen“ in Braunschweig, des Fraunhofer-Instituts für Toxikologie und Experimentelle Medizin und der Berliner Charité. „Phage4Cure ist angetreten, die Phagentherapie zu etablieren“, sagt Martin Witzenrath von der Infektiologie und Pneumologie-Klinik der Berliner Charité. Fünf Millionen Euro hat das Bundesministerium 2017 für Bildung und Forschung für das Projekt freigestellt.
Bislang haben die Forscher bereits geeignete Phagen isoliert und charakterisiert, nun seien sie auch mit der Produktion großer Mengen von Phagen „fast fertig“, so dass bereits im Juni die ersten präklinischen Tests beginnen sollen, sagt Witzenrath. An Menschen, zunächst freiwilligen gesunden Probanden im Rahmen einer Phase-1-Studie, sollen die Viren im Laufe des kommenden Jahres getestet werden. Erst nach diesen Sicherheitschecks sollen Patienten mit chronischer Infektion durch Pseudomonas aeruginosa mit den Bakteriophagen behandelt werden.
In einer großangelegten Studie konnten die Bakterienfresser nicht überzeugen
„Ich bin überzeugt davon, dass Phagentherapie funktionieren kann, sonst würden wir das nicht machen“, sagt Witzenrath. Dennoch weiß der Mediziner um die Misserfolge vorhergehender Therapieversuche mit Bakteriophagen. So haben die Viren etwa in der einzigen größeren Studie in der Europäischen Union, der 2013 von der französischen Firma Pherecydes Pharma gestarteten „PhagoBurn“, nicht überzeugen können. Dabei wurde eine Mischung von zwölf verschiedenen Phagen in die Wunden von 220 Patienten mit Verbrennungen gesprüht, um die Infektion mit mehrfach Antibiotika-resistenten Bakterien vom Typ Pseudomonas aeruginosa zu stoppen. Allerdings ließ sich gegenüber der Kontrollgruppe von Patienten, deren Wunden standardmäßig desinfiziert wurden, nicht nur kein Vorteil der Phagentherapie feststellen, sondern die Standardtherapie war sogar besser. „Daher ist es gut und wichtig, dass wir diese Therapieoption kritisch hinterfragen und ihre Wirksamkeit genauso streng testen wie jede andere neue Behandlungsform auch“, sagt Witzenrath.
Positive Erfahrungen werden vor allem aus einer Klinik in Tiflis in Georgien berichtet. Sie wurde von dem Bakteriologen George Eliava 1923 gegründet, der zuvor mit dem britisch-kanadischen Mikrobiologen Felix d’Hérelle vom Pariser Pasteur-Institut zusammengearbeitet hatte. D’Hérelle war 1917 als Erstem aufgefallen, dass sich im Stuhl von Durchfallpatienten immer dann Unmengen von Bakteriophagen fanden, wenn diese sich von der Darminfektion gerade erholten. Die naheliegende Therapie-Idee entwickelten Eliava und seine Nachfolger dann in der Sowjetunion weiter – bis heute. Im Westen hingegen gerieten die Phagen als Therapeutikum in Vergessenheit, als die Antibiotika aufkamen. Erst seit diese Wirkstoffe zu versagen drohen, gewinnt das Konzept wieder an Aufmerksamkeit – wie auch die Eliava-Klinik.
Allerdings lebe dieses Institut auch davon, dass diese Therapie dort angeboten wird, sagt Witzenrath. Die Ärzte könnten also bezüglich der Einschätzung der Wirksamkeit der Methode voreingenommen sein – jedenfalls sei es dort womöglich besonders schwierig, das zu verhindern. Denn so einleuchtend es sein mag, dass Bakteriophagen Bakterien abtöten, gebe es viele Faktoren, die den Erfolg einer Phagentherapie zunichte machen können. „Es ist zum Beispiel alles andere als trivial, dass die Phagen die Bakterien in den für sie riesigen Organen überhaupt finden“, sagt Witzenrath. Vor Ort müssten die Phagen zudem Hindernisse wie eitrige Schleimschichten oder Biofilme überwinden. Und schließlich müssten genügend Bakterien in der Nähe sein und infiziert werden, damit die Phagen sich vermehren und dann wieder andere Bakterien befallen können. Man müsse einfach noch sehr viel lernen und erforschen über das Zusammenspiel von Phagen und Bakterien, um eine wirksame Therapie zu entwickeln.
- showPaywall:
- false
- isSubscriber:
- false
- isPaid: